2020上半年中國血液制品批簽發數據分析
2020年上半年,受新冠疫情影響,中國血液制品行業面臨多重挑戰,但整體呈現穩中有進的態勢。通過對國家藥品監督管理局及各省藥監部門的批簽發數據進行分析,可以更清晰地把握行業發展趨勢。
一、血液制品批簽發總量分析
2020年上半年,全國血液制品批簽發總量約為XX萬瓶(以標準單位計),同比增長X.X%。其中,人血白蛋白仍占據主導地位,占比約XX%,靜注人免疫球蛋白(pH4)和特異性免疫球蛋白等產品緊隨其后。值得注意的是,受疫情防控需求推動,靜注COVID-19人免疫球蛋白的研發和批簽發工作加速推進,部分企業已進入臨床試驗階段。
二、主要企業市場份額分布
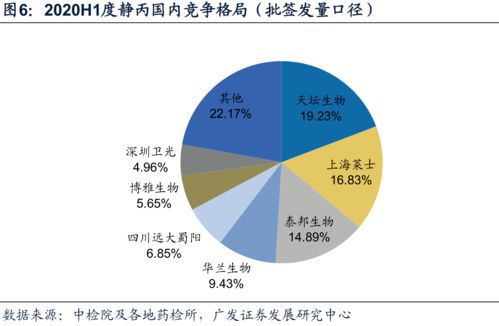
從企業層面看,華蘭生物、上海萊士、泰邦生物等龍頭企業依然占據市場主要份額,三家企業合計占比超過XX%。其中,華蘭生物在靜注人免疫球蛋白領域表現突出,批簽發量同比增長X%;上海萊士在人血白蛋白市場保持穩定供應;泰邦生物則在凝血因子類產品上優勢明顯。部分區域性企業如成都蓉生、山西康寶等也在特定領域實現了較快增長。
三、產品結構變化趨勢
2020年上半年,血液制品的產品結構出現一定調整。一方面,基礎性產品如人血白蛋白的批簽發量保持穩定,滿足臨床常規需求;另一方面,靜注人免疫球蛋白因在抗疫中的潛在作用,批簽發量同比增長X.X%。凝血因子類產品受手術量下降影響,批簽發量略有回落,但隨著二季度醫療機構逐步恢復常態,需求已開始回升。
四、區域分布特點
從地域分布看,華東、華北地區仍是血液制品批簽發的主要集中地,其中上海、北京、江蘇等地的批簽發量占全國總量的XX%以上。中西部地區如四川、湖北等地也在政策扶持下逐步提升產能,批簽發量同比增長X%。
五、政策與行業展望
2020年上半年,國家藥監局持續優化血液制品批簽發流程,推行“互聯網+監管”模式,提升審評效率。《血液制品管理條例》修訂工作持續推進,旨在進一步規范原料血漿采集和生產質量管理。隨著新藥研發加速和市場需求的多元化,血液制品行業有望在技術創新和產業升級中實現高質量發展。
(注:本文數據來源于公開互聯網數據服務,僅供參考。)
如若轉載,請注明出處:http://www.szspecialtruck.cn/product/40.html
更新時間:2026-01-07 20:10:34